Bränslecellär en elektrokemisk anordning som liknar en galvanisk cell, men skiljer sig från den genom att ämnena för elektro kemisk reaktion tillförs den utifrån - i motsats till den begränsade mängden energi som lagras i en galvanisk cell eller batteri.

Tekniken och infrastrukturen som behövs för att distribuera vätgas kan dock fortfarande vara decennier borta. Det finns bara en vätgasdriven bil vid sidan av vägen, så ingen rusar för att bygga en vätgasmack. Och när väte är svårt att få fram, produktion bränsleceller också oviktigt, så de förblir dyra och tillgängliga för alla.
De utvecklade en bränslecell med oktan. Oktan är huvudkomponenten i bensin, och förare som har dessa bränsleceller i sina bilar kommer att kunna fylla tanken nästan var som helst. Oktanig bränslecell. I produktionen av vattenmeloner inne i buren växer hans skratt.
Ris. 1. Vissa bränsleceller
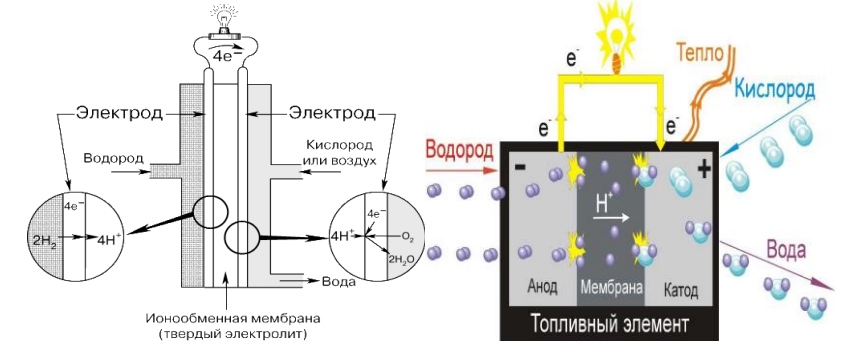
Bränsleceller omvandlar bränslets kemiska energi till elektricitet och kringgår ineffektiva förbränningsprocesser som sker med stora förluster. De omvandlar väte och syre till elektricitet genom en kemisk reaktion. Som ett resultat av denna process bildas vatten och en stor mängd värme frigörs. En bränslecell är ungefär som ett batteri som kan laddas och sedan använda den lagrade elektriska energin. Uppfinnaren av bränslecellen anses vara William R. Grove, som uppfann den redan 1839. Denna bränslecell använde en svavelsyralösning som elektrolyt och väte som bränsle, som kombinerades med syre i ett oxidationsmedel. Fram till nyligen användes bränsleceller endast i laboratorier och på rymdfarkoster.
Innan du försöker använda en katalysator för att ta bort bensin, diesel eller naturgas från en reservoar. De misslyckades eftersom kol uppträder på anoden under kolvätesönderdelning och minskar cellens effektivitet. Dessutom sker processen endast vid en relativt hög temperatur, vilket innebär att reformern måste värmas upp och då är det totala missnöjet med systemet endast 29 procent.
I Scott Barnetts avancerade system är bränslecells- och reformerfunktionerna kombinerade i en enhet – den överdrivna mängden väte som produceras genom att kombinera syre används för att stimulera väteproduktionen. Synden på systemet borde nå till och med 50 procent.
Ris. 2.
Till skillnad från andra kraftgeneratorer, såsom förbränningsmotorer eller turbiner som drivs av gas, kol, eldningsolja, etc., förbränner bränsleceller inte bränsle. Detta innebär inga bullriga högtrycksrotorer, inga höga avgasljud, inga vibrationer. Bränsleceller producerar elektricitet genom en tyst elektrokemisk reaktion. En annan egenskap hos bränsleceller är att de omvandlar bränslets kemiska energi direkt till el, värme och vatten.
Problemet med anodisk ureterisering löstes genom att belägga zinkelektroden med zirkoniumoxid blästrad mellan två skikt av ruteniumoxid och ceriumoxid. Beläggningsytan katalyserar koloxidbindningsreaktionen så att inget fast sot bildas och allt kol frigörs som koldioxid. Detta bekräftades experimentellt när bensinisooktan tillfördes bränslecellen.
Det bör noteras att start på sådana komponenter endast kan användas för sekundära energikällor.
Problemet med anodisk ureterisering löstes genom att belägga zinkelektroden med zirkoniumoxid blästrad mellan två skikt av ruteniumoxid och ceriumoxid. Beläggningsytan katalyserar koloxidbindningsreaktionen så att inget fast sot bildas och allt kol frigörs som koldioxid. Detta bekräftades experimentellt när bensinisooktan tillfördes bränslecellen.
Bränsleceller är mycket effektiva och producerar inte stora mängder växthusgaser som koldioxid, metan och dikväveoxid. De enda utsläppen från bränsleceller är vatten i form av ånga och en liten mängd koldioxid, som inte släpps ut alls om rent väte används som bränsle. Bränsleceller sätts samman till enheter och sedan till individuella funktionsmoduler.
Bränsleceller har inga rörliga delar (åtminstone inte i själva cellen) och följer därför inte Carnots lag. Det vill säga, de kommer att ha mer än 50 % effektivitet och är särskilt effektiva vid låga belastningar. Bränslecellsbilar kan alltså bli (och har redan visat sig vara) mer bränsleeffektiva än konventionella bilar under verkliga körförhållanden.
Bränslecellen producerar elektrisk ström DC spänning, som kan användas för att driva en elmotor, belysningssystem och andra elektriska system i bilen.
Det finns flera typer av bränsleceller som skiljer sig åt i de som används kemiska processer. Bränsleceller klassificeras vanligtvis efter vilken typ av elektrolyt de använder.
Vissa typer av bränsleceller är lovande för användning som kraftverk, medan andra är lovande för bärbara enheter eller för att köra bilar.
1. Alkaliska bränsleceller (ALFC)
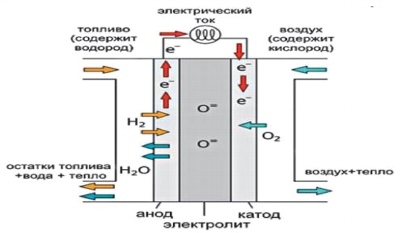
Alkalisk bränslecell– Det här är ett av de allra första elementen som utvecklats. Alkaliska bränsleceller (AFC) är en av de mest studerade teknologierna, som använts sedan mitten av 60-talet av 1900-talet av NASA i programmen Apollo och rymdfärja. Ombord på dessa rymdskepp Bränsleceller producerar elektrisk energi och dricksvatten.
Ris. 3.
Alkaliska bränsleceller är en av de mest effektiva cellerna som används för att generera elektricitet, med en kraftgenereringseffektivitet på upp till 70 %.
Alkaliska bränsleceller använder en elektrolyt, en vattenlösning av kaliumhydroxid, som finns i en porös, stabiliserad matris. Kaliumhydroxidkoncentrationen kan variera beroende på bränslecellens driftstemperatur, som sträcker sig från 65°C till 220°C. Laddningsbäraren i SHTE är hydroxyljonen (OH-), som rör sig från katoden till anoden, där den reagerar med väte och producerar vatten och elektroner. Vattnet som produceras vid anoden rör sig tillbaka till katoden och genererar återigen hydroxyljoner där. Som ett resultat av denna serie av reaktioner som äger rum i bränslecellen, produceras elektricitet och, som en biprodukt, värme:
Reaktion vid anoden: 2H2 + 4OH- => 4H2O + 4e
Reaktion vid katoden: O2 + 2H2O + 4e- => 4OH
Allmän reaktion av systemet: 2H2 + O2 => 2H2O
Fördelen med SHTE är att dessa bränsleceller är billigast att tillverka, eftersom katalysatorn som behövs på elektroderna kan vara något av de ämnen som är billigare än de som används som katalysatorer för andra bränsleceller. Dessutom arbetar SHTE vid relativt låga temperaturer och är bland de mest effektiva.
En av de karakteristiska egenskaperna hos SHTE är dess höga känslighet för CO2, som kan finnas i bränsle eller luft. CO2 reagerar med elektrolyten, förgiftar den snabbt och minskar bränslecellens effektivitet kraftigt. Därför är användningen av SHTE begränsad till slutna utrymmen, såsom rymdfarkoster och undervattensfarkoster, de arbetar på rent väte och syre.
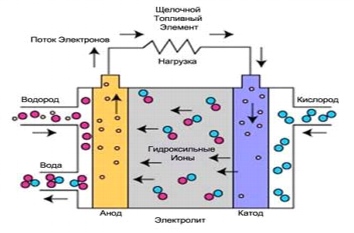
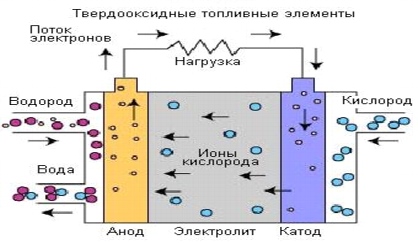
2. Smält karbonatbränsleceller (MCFC)
Bränsleceller med smält karbonatelektrolytär högtemperaturbränsleceller. Den höga driftstemperaturen tillåter direkt användning av naturgas utan bränsleprocessor och bränslegas med lågt värmevärde från industriella processer och andra källor. Denna process utvecklades i mitten av 60-talet av 1900-talet. Sedan dess har produktionsteknik, prestanda och tillförlitlighet förbättrats.
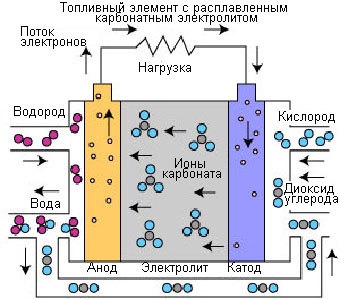
Ris. 4.
Driften av RCFC skiljer sig från andra bränsleceller. Dessa celler använder en elektrolyt gjord av en blandning av smälta karbonatsalter. För närvarande används två typer av blandningar: litiumkarbonat och kaliumkarbonat eller litiumkarbonat och natriumkarbonat. För att smälta karbonatsalter och uppnå en hög grad av jonrörlighet i elektrolyten sker driften av bränsleceller med en smält karbonatelektrolyt kl. höga temperaturer(650°C). Verkningsgraden varierar mellan 60-80%.
Vid uppvärmning till en temperatur av 650°C blir salterna en ledare för karbonatjoner (CO32-). Dessa joner passerar från katoden till anoden, där de kombineras med väte för att bilda vatten, koldioxid och fria elektroner. Dessa elektroner är riktade längs det yttre elektrisk krets tillbaka till katoden, som genererar elström och värme som en biprodukt.
Reaktion vid anoden: CO32- + H2 => H2O + CO2 + 2e
Reaktion vid katoden: CO2 + 1/2O2 + 2e- => CO32-
Generell reaktion av elementet: H2(g) + 1/2O2(g) + CO2(katod) => H2O(g) + CO2(anod)
De höga driftstemperaturerna för bränsleceller med smält karbonatelektrolyt har vissa fördelar. Fördelen är möjligheten att använda standardmaterial (rostfria stålplåtar och nickelkatalysator på elektroderna). Spillvärmen kan användas för att producera högtrycksånga. Höga reaktionstemperaturer i elektrolyten har också sina fördelar. Användningen av höga temperaturer kräver lång tid för att uppnå optimala driftsförhållanden, och systemet reagerar långsammare på förändringar i energiförbrukningen. Dessa egenskaper tillåter användning av bränslecellsinstallationer med smält karbonatelektrolyt under konstanta effektförhållanden. Höga temperaturer förhindrar skador på bränslecellen genom kolmonoxid, "förgiftning" etc.
Bränsleceller med smält karbonatelektrolyt är lämpliga för användning i stora stationära installationer. Termiska kraftverk med en elektrisk uteffekt på 2,8 MW produceras kommersiellt. Anläggningar med uteffekt upp till 100 MW utvecklas.
3. Fosforsyrabränsleceller (PAFC)
Bränsleceller baserade på fosforsyra (ortofosforsyra). blev de första bränslecellerna för kommersiellt bruk. Denna process utvecklades i mitten av 60-talet av 1900-talet, tester har utförts sedan 70-talet av 1900-talet. Resultatet blev ökad stabilitet och prestanda och minskade kostnader.
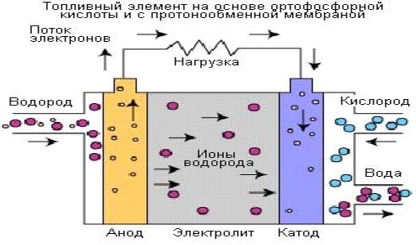
Ris. 5.
Fosforsyra (ortofosforsyra) bränsleceller använder en elektrolyt baserad på ortofosforsyra (H3PO4) i koncentrationer upp till 100 %. Fosforsyrans jonledningsförmåga är låg vid låga temperaturer, så dessa bränsleceller används vid temperaturer upp till 150-220 °C.
Laddningsbärare i bränsleceller av denna typär väte (H+, proton). En liknande process sker i protonbytesmembranbränsleceller (PEMFCs), där väte som tillförs anoden delas upp i protoner och elektroner. Protoner färdas genom elektrolyten och kombineras med syre från luften vid katoden för att bilda vatten. Elektronerna skickas genom en extern elektrisk krets och genererar därigenom en elektrisk ström. Nedan visas reaktioner som genererar elektrisk ström och värme.
Reaktion vid anoden: 2H2 => 4H+ + 4e
Reaktion vid katoden: O2(g) + 4H+ + 4e- => 2H2O
Generell reaktion av elementet: 2H2 + O2 => 2H2O
Verkningsgraden för bränsleceller baserade på fosforsyra (ortofosforsyra) är mer än 40 % när de genererar elektrisk energi. Med kombinerad produktion av värme och el är den totala verkningsgraden cirka 85 %. Dessutom, givet driftstemperaturer, kan spillvärme användas för att värma vatten och generera ånga med atmosfärstryck.
Den höga prestandan hos värmekraftverk som använder bränsleceller baserade på fosforsyra (ortofosforsyra) i den kombinerade produktionen av termisk och elektrisk energi är en av fördelarna med denna typ av bränsleceller. Enheterna använder kolmonoxid med en koncentration på cirka 1,5 %, vilket avsevärt utökar valet av bränsle. Enkel design, låg grad av elektrolytflyktighet och ökad stabilitet är också fördelar med sådana bränsleceller.
Termiska kraftverk med elektrisk uteffekt på upp till 400 kW är kommersiellt producerade. Anläggningar med en kapacitet på 11 MW har genomgått lämpliga tester. Anläggningar med uteffekt upp till 100 MW utvecklas.
4. Protonutbytesmembranbränsleceller (PEMFC)
Protonbytesmembranbränsleceller anses vara den bästa typen av bränsleceller för att generera kraft till fordon, som kan ersätta bensin- och dieselförbränningsmotorer. Dessa bränsleceller användes först av NASA för Gemini-programmet. Installationer baserade på MOPFC med effekt från 1 W till 2 kW har utvecklats och demonstrerats.

Ris. 6.
Elektrolyten i dessa bränsleceller är ett fast polymermembran (en tunn film av plast). När den är mättad med vatten tillåter denna polymer protoner att passera igenom men leder inte elektroner.
Bränslet är väte och laddningsbäraren är en vätejon (proton). Vid anoden delas vätemolekylen i en vätejon (proton) och elektroner. Vätejoner passerar genom elektrolyten till katoden, och elektroner rör sig runt den yttre cirkeln och producerar elektrisk energi. Syre, som tas från luften, tillförs katoden och kombineras med elektroner och vätejoner för att bilda vatten. Följande reaktioner sker vid elektroderna: Reaktion vid anoden: 2H2 + 4OH- => 4H2O + 4eReaktion vid katoden: O2 + 2H2O + 4e- => 4OH Total cellreaktion: 2H2 + O2 => 2H2O Jämfört med andra typer av bränsleceller producerar bränsleceller med ett protonbytesmembran mer energi för en given volym eller vikt av bränslecellen. Denna funktion gör att de är kompakta och lätta. Dessutom är driftstemperaturen mindre än 100°C, vilket gör att du snabbt kan starta driften. Dessa egenskaper, liksom förmågan att snabbt ändra energiproduktionen, är bara några som gör dessa bränsleceller till en utmärkt kandidat för användning i fordon.
En annan fördel är att elektrolyten är en fast substans snarare än en vätska. Det är lättare att hålla kvar gaser vid katoden och anoden med en fast elektrolyt, så sådana bränsleceller är billigare att tillverka. Med en fast elektrolyt finns det inga orienteringsproblem och färre korrosionsproblem, vilket ökar livslängden på cellen och dess komponenter.
Ris. 7.
5. Fastoxidbränsleceller (SOFC)
Fastoxidbränslecellerär bränslecellerna med högsta driftstemperatur. Driftstemperatur kan variera från 600°C till 1000°C, vilket möjliggör användning olika typer bränsle utan speciella förbehandling. För att hantera så höga temperaturer är elektrolyten som används en tunn fast metalloxid på keramisk bas, ofta en legering av yttrium och zirkonium, som är en ledare av syrejoner (O2-). Tekniken för att använda fastoxidbränsleceller har utvecklats sedan slutet av 50-talet av 1900-talet och har två konfigurationer: plana och rörformiga.
Den fasta elektrolyten ger en förseglad övergång av gas från en elektrod till en annan, medan flytande elektrolyter är belägna i ett poröst substrat. Laddningsbäraren i bränsleceller av denna typ är syrejonen (O2-). Vid katoden separeras syremolekyler från luften i en syrejon och fyra elektroner. Syrejoner passerar genom elektrolyten och kombineras med väte, vilket skapar fyra fria elektroner. Elektronerna skickas genom en extern elektrisk krets och genererar elektrisk ström och spillvärme.
Ris. 8.
Reaktion vid anoden: 2H2 + 2O2- => 2H2O + 4e
Reaktion vid katoden: O2 + 4e- => 2O2-
Generell reaktion av elementet: 2H2 + O2 => 2H2O
Effektiviteten i produktionen av elektrisk energi är den högsta av alla bränsleceller – cirka 60 %. Dessutom möjliggör höga driftstemperaturer en kombinerad produktion av termisk och elektrisk energi för att generera högtrycksånga. Att kombinera en högtemperaturbränslecell med en turbin gör det möjligt att skapa en hybridbränslecell för att öka effektiviteten för att generera elektrisk energi med upp till 70 %.
Bränsleceller med fast oxid arbetar vid mycket höga temperaturer (600°C-1000°C), vilket resulterar i betydande tid som krävs för att uppnå optimala driftsförhållanden och ett långsammare systemsvar på förändringar i energiförbrukningen. Vid så höga driftstemperaturer krävs ingen omvandlare för att återvinna väte från bränslet, vilket gör att värmekraftverket kan arbeta med relativt orena bränslen som härrör från förgasning av kol eller avfallsgaser etc. Bränslecellen är också utmärkt för högeffektapplikationer, inklusive industriella och stora centrala kraftverk. Moduler med en elektrisk uteffekt på 100 kW tillverkas kommersiellt.
6. Bränsleceller för direkt metanoloxidation (DOMFC)
Bränsleceller för direkt metanoloxidation De används framgångsrikt inom området för att driva mobiltelefoner, bärbara datorer, samt för att skapa bärbara strömkällor, vilket är vad den framtida användningen av sådana element syftar till.
Konstruktionen av bränsleceller med direkt oxidation av metanol liknar konstruktionen av bränsleceller med protonbytesmembran (MEPFC), d.v.s. En polymer används som elektrolyt och en vätejon (proton) används som laddningsbärare. Men flytande metanol (CH3OH) oxiderar i närvaro av vatten vid anoden och frigör CO2, vätejoner och elektroner, som skickas genom en extern elektrisk krets och därigenom genererar en elektrisk ström. Vätejoner passerar genom elektrolyten och reagerar med syre från luften och elektroner från den externa kretsen för att bilda vatten vid anoden.
Reaktion vid anoden: CH3OH + H2O => CO2 + 6H+ + 6eReaktion vid katoden: 3/2O2 + 6H+ + 6e- => 3H2O Generell reaktion av elementet: CH3OH + 3/2O2 => CO2 + 2H2O Utvecklingen av sådana bränsleceller har utförts sedan början av 90-talet av 1900-talet och deras specifika kraft och effektivitet ökades till 40%.
Dessa element testades i temperaturområdet 50-120°C. På grund av deras låga driftstemperaturer och frånvaron av behov av en omvandlare är sådana bränsleceller den bästa kandidaten för båda mobiltelefoner och andra konsumtionsvaror, samt i bilmotorer. Deras fördel är också deras lilla storlek.
7. Polymerelektrolytbränsleceller (PEFC)
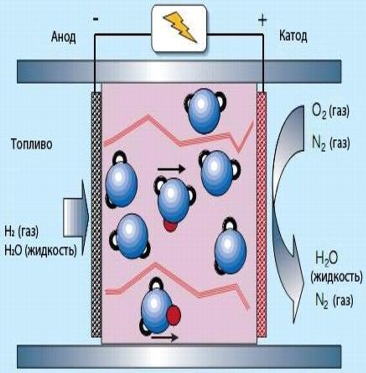
När det gäller polymerelektrolytbränsleceller består polymermembranet av polymerfibrer med vattenområden i vilka ledningsvattenjoner H2O+ (proton, röd) fäster till en vattenmolekyl. Vattenmolekyler utgör ett problem på grund av långsamt jonbyte. Därför krävs en hög koncentration av vatten både i bränslet och vid utloppselektroderna, vilket begränsar driftstemperaturen till 100°C.
8. Fasta sura bränsleceller (SFC)
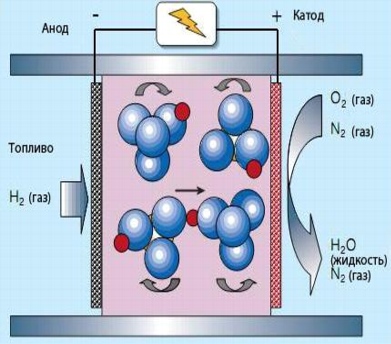
I fasta sura bränsleceller innehåller elektrolyten (CsHSO4) inte vatten. Driftstemperaturen är därför 100-300°C. Rotationen av SO42-oxianjonerna gör att protonerna (röda) kan röra sig som visas i figuren. Vanligtvis är en fast syrabränslecell en sandwich där ett mycket tunt lager av fast syraförening är inklämt mellan två elektroder som är tätt sammanpressade för att säkerställa god kontakt. Vid upphettning avdunstar den organiska komponenten och kommer ut genom porerna i elektroderna, vilket bibehåller förmågan till flera kontakter mellan bränslet (eller syret i den andra änden av elementet), elektrolyten och elektroderna.
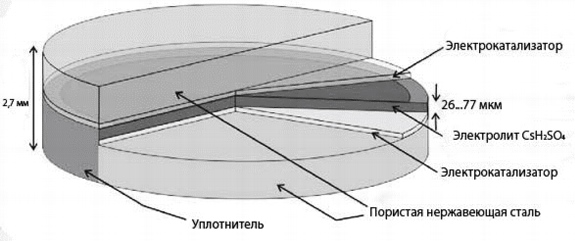
Ris. 9.
9. Jämförelse av de viktigaste egenskaperna hos bränsleceller
Bränslecellstyp | Driftstemperatur | Kraftgenereringseffektivitet | Bränsletyp | Tillämpningsområde |
Medelstora och stora installationer |
||||
Rent väte | installationer |
|||
Rent väte | Små installationer |
|||
De flesta kolvätebränslen | Små, medelstora och stora installationer |
|||
Bärbar installationer |
||||
Rent väte | Utrymme forskat |
|||
Rent väte | Små installationer |
Ris. 10.
10. Användning av bränsleceller i bilar
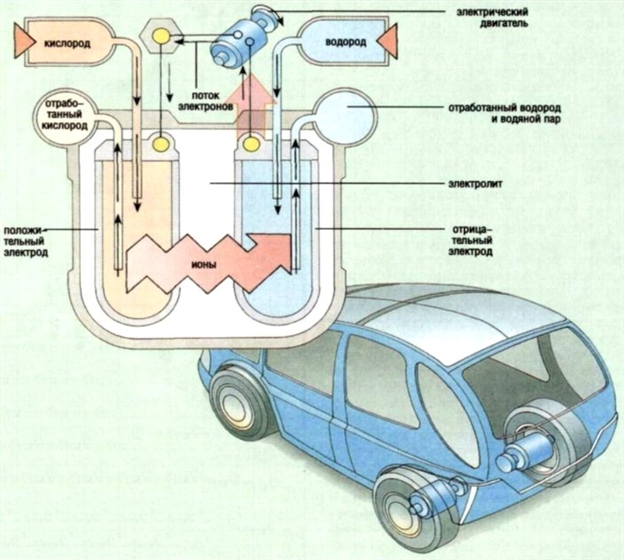
Ris. 11.

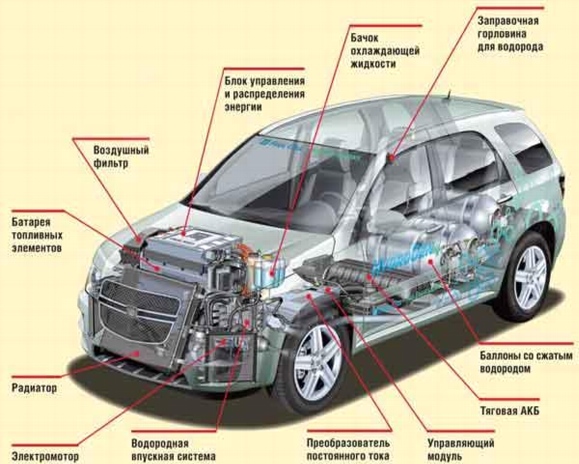
Ris. 12.
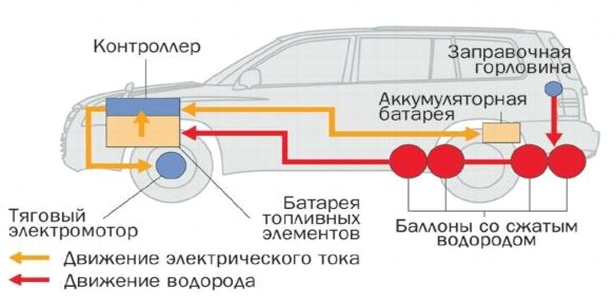
Nissan vätebränslecell
Mobilelektroniken förbättras varje år, blir mer utbredd och tillgänglig: handdatorer, bärbara datorer, mobila och digitala enheter, fotoramar, etc. Alla uppdateras ständigt med nya funktioner, större bildskärmar, trådlös kommunikation, starkare processorer, samtidigt som de minskar i storlek . Kraftteknologier, till skillnad från halvledarteknik, går inte framåt med stormsteg.
De befintliga batterierna och ackumulatorerna för att driva branschens prestationer blir otillräckliga, så frågan om alternativa källor är mycket akut. Bränsleceller är överlägset flest lovande riktning. Principen för deras funktion upptäcktes redan 1839 av William Grove, som genererade elektricitet genom att ändra elektrolysen av vatten.
Vad är bränsleceller?
Video: Dokumentär, bränsleceller för transport: dåtid, nutid, framtid
Bränsleceller är av intresse för biltillverkarna, och rymdskeppsdesigners är också intresserade av dem. 1965 testades de till och med av Amerika på rymdfarkosten Gemini 5 som skjuts upp i rymden, och senare på Apollo. Miljontals dollar hälls i bränslecellsforskning idag eftersom föroreningsproblemen kvarstår. miljö, ökande utsläpp av växthusgaser som genereras vid förbränning av organiskt bränsle, vars reserver inte heller är oändliga.
En bränslecell, ofta kallad en elektrokemisk generator, fungerar på det sätt som beskrivs nedan.
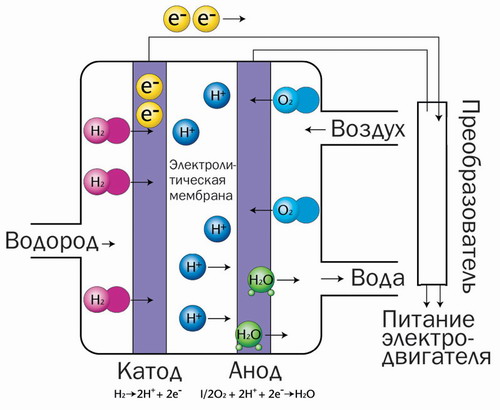
Att vara som ackumulatorer och batterier galvanisk cell, men med skillnaden att de aktiva substanserna förvaras i den separat. De tillförs elektroderna allt eftersom de används. Naturligt bränsle eller något ämne som erhålls från det brinner på den negativa elektroden, som kan vara gasformigt (väte, till exempel, och kolmonoxid) eller flytande, som alkoholer. Syre reagerar vanligtvis vid den positiva elektroden.
Men den till synes enkla driftprincipen är inte lätt att omsätta till verklighet.
DIY bränslecell
Video: DIY vätebränslecell
Tyvärr har vi inga fotografier på hur detta bränsleelement ska se ut, vi litar på din fantasi.
Du kan göra en lågeffektbränslecell med dina egna händer även i ett skollaboratorium. Du behöver fylla på med en gammal gasmask, flera bitar plexiglas, alkali och vattenlösning etanol(enklare, vodka), som kommer att fungera som "bränsle" för bränslecellen.

Först och främst behöver du ett hölje för bränslecellen, som bäst är tillverkad av plexiglas, minst fem millimeter tjockt. De inre skiljeväggarna (det finns fem fack inuti) kan göras lite tunnare - 3 cm För att limma plexiglas, använd lim av följande sammansättning: sex gram plexiglasspån löses i hundra gram kloroform eller dikloretan (arbetet är gjort. under huven).
Nu måste du borra ett hål i ytterväggen, i vilket du måste sätta in ett glasavloppsrör med en diameter på 5-6 centimeter genom en gummipropp.
Alla vet att i det periodiska systemet finns de mest aktiva metallerna i det nedre vänstra hörnet, och högaktiva metalloider finns i tabellens övre högra hörn, d.v.s. förmågan att donera elektroner ökar från topp till botten och från höger till vänster. Element som under vissa förutsättningar kan visa sig som metaller eller metalloider finns i mitten av bordet.
Nu häller vi aktivt kol från gasmasken i den andra och fjärde avdelningen (mellan den första partitionen och den andra, såväl som den tredje och fjärde), som kommer att fungera som elektroder. För att förhindra att kol rinner ut genom hålen kan du lägga det i nylontyg (nylonstrumpor för damer är lämpliga). I
Bränslet kommer att cirkulera i den första kammaren, och i den femte bör det finnas en syreleverantör - luft. Det kommer att finnas en elektrolyt mellan elektroderna, och för att förhindra att den läcker in i luftkammaren, innan du fyller den fjärde kammaren med kol för luftelektrolyten, måste du blötlägga den med en lösning av paraffin i bensin (förhållande av 2 gram paraffin till ett halvt glas bensin). På lagret av kol måste du placera (genom att trycka lätt) kopparplattor till vilka ledningarna är lödda. Genom dem kommer strömmen att avledas från elektroderna.
Allt som återstår är att ladda elementet. För detta behöver du vodka, som måste spädas med vatten 1:1. Tillsätt sedan försiktigt trehundra till trehundrafemtio gram kaustikt kalium. För elektrolyten löses 70 gram kaliumhydroxid i 200 gram vatten.
Bränslecellen är redo för testning. Nu måste du samtidigt hälla bränsle i den första kammaren och elektrolyt i den tredje. En voltmeter kopplad till elektroderna ska visa från 07 volt till 0,9. För att säkerställa kontinuerlig drift av elementet är det nödvändigt att ta bort använt bränsle (tömma i ett glas) och tillsätta nytt bränsle (genom ett gummirör). Matningshastigheten justeras genom att klämma ihop röret. Så här ser driften av en bränslecell ut under laboratorieförhållanden, vars effekt är förståeligt låg.
Video: Bränslecell eller evigt batteri hemma
För att säkerställa större makt har forskare arbetat med detta problem under lång tid. Det aktiva stålet i utvecklingen rymmer metanol- och etanolbränsleceller. Men tyvärr har de ännu inte omsatts i praktiken.
Varför bränslecellen väljs som alternativ kraftkälla

En bränslecell valdes som alternativ kraftkälla, eftersom slutprodukten av väteförbränning i den är vatten. Problemet gäller bara att hitta billiga och effektivt sätt erhållande av väte. Enorma medel investerade i utvecklingen av vätegeneratorer och bränsleceller kan inte annat än bära frukt, så ett tekniskt genombrott och deras faktiska användning i vardagsliv, bara en tidsfråga.
Redan idag fordonsindustrins monster: General Motors, Honda, Draimler Coyler, Ballard demonstrerar bussar och bilar som körs på bränsleceller, vars effekt når 50 kW. Men problemen med deras säkerhet, tillförlitlighet och kostnad har ännu inte lösts. Som redan nämnts, till skillnad från traditionella kraftkällor - batterier och ackumulatorer, i detta fall tillförs oxidationsmedlet och bränslet från utsidan, och bränslecellen är bara en mellanhand i den pågående reaktionen av att bränna bränsle och omvandla den frigjorda energin till elektricitet. "Förbränning" uppstår endast om elementet levererar ström till lasten, som en dieselelektrisk generator, men utan en generator och en dieselmotor, och även utan buller, rök och överhettning. Samtidigt är effektiviteten mycket högre, eftersom det inte finns några mellanliggande mekanismer.
Video: Vätgasbränslecellsbil
Stora förhoppningar ställs till användningen av nanoteknik och nanomaterial, vilket kommer att hjälpa till att miniatyrisera bränsleceller samtidigt som de ökar deras kraft. Det har förekommit rapporter om att ultraeffektiva katalysatorer har skapats, liksom design för bränsleceller som inte har membran. I dem tillförs bränsle (metan, till exempel) till elementet tillsammans med oxidationsmedlet. Intressanta lösningar använder syre löst i luft som oxidationsmedel, och organiska föroreningar som ackumuleras i förorenat vatten som bränsle. Dessa är så kallade biobränsleelement.
Bränsleceller, enligt experter, kan komma in på massmarknaden under de kommande åren.





