כדי לבסס את תכונותיו של חומר יש צורך בצורתו הטהורה, אך חומרים אינם מופיעים בטבע בצורתם הטהורה.כל חומר מכיל תמיד כמות מסוימת של זיהומים. חומר שכמעט ואין בו זיהומים נקרא טהור. הם עובדים עם חומרים כאלה במעבדה מדעית או במעבדה לכימיה בבית הספר. שימו לב כי חומרים טהורים לחלוטין אינם קיימים.
תערובות הן כמעט כל החומרים הטבעיים, מוצרי מזון (למעט מלח, סוכר, כמה אחרים), חומרי בנייה, כימיקלים ביתיים, תרופות רבות ומוצרי קוסמטיקה.
חומרים טבעיים הם תערובות, לעתים מורכבות ממספר רב מאוד של חומרים שונים. לדוגמה, מים טבעיים מכילים תמיד מלחים וגזים מומסים בהם. לפעמים כמות קטנה מאוד של טומאה יכולה להוביל לשינוי חזק מאוד בתכונות מסוימות של החומר. לדוגמה, תכולת המאיות בלבד של ברזל או נחושת באבץ מאיצה את האינטראקציה שלו עם חומצה הידרוכלורית מאות פעמים. כאשר אחד החומרים נמצא בכמות דומיננטית בתערובת, התערובת כולה נושאת בדרך כלל את שמה.
רכיב הוא כל חומר הכלול בתערובת.
תערובות הומוגניות.
מוסיפים מנת סוכר קטנה לכוס מים ומערבבים עד שכל הסוכר נמס. לנוזל יהיה טעם מתוק. כך, הסוכר לא נעלם, אלא נשאר בתערובת. אבל לא נראה את הגבישים שלו, גם כשבודקים טיפת נוזל דרך מיקרוסקופ רב עוצמה.

אורז. 3. תערובת הומוגנית ( פתרון מיםסהרה)
התערובת המוכנה של סוכר ומים היא הומוגנית (איור 3); החלקיקים הקטנים ביותר של חומרים אלה מעורבבים בו באופן שווה.
תערובות שבהן לא ניתן לזהות רכיבים בעין בלתי מזוינת נקראות הומוגניות.
מים מעורבבים בחול, גיר או חימר קופאים בטמפרטורה של O 0 C ורותחים ב 100 0 C.
לסוגים מסוימים של תערובות הטרוגניות יש שמות מיוחדים: קצף (לדוגמה, קצף פוליסטירן, קצף סבון), תרחיף (תערובת של מים עם כמות קטנה של קמח), אמולסיה (חלב, שמן צמחי מעורער היטב ומים), אירוסול ( עשן, ערפל).

אורז. 5. תערובות הטרוגניות:
א - תערובת של מים וגופרית;
ב - תערובת של שמן צמחי ומים;
ג - תערובת של אוויר ומים
קיימים דרכים שונותהפרדת תערובות. בחירת השיטה להפרדת תערובת מושפעת מתכונות החומרים היוצרים את התערובת.

בואו נסתכל מקרוב על כל שיטה:
פְּרַקְלִיטוּת- שיטה נפוצה לטיהור נוזלים מזיהומים מכניים שאינם מסיסים במים, אוחומרים נוזליים שאינם מסיסים זה בזה ובעלי צפיפות שונה.
התיישבות משמשת בהכנת מים לטכנולוגיות ו צרכי הבית, טיפול בשפכים, התייבשות והפלת נפט גולמי, בתהליכים רבים טכנולוגיה כימית. זהו שלב חשוב בטיהור עצמי טבעי של מאגרים טבעיים ומלאכותיים.
סִנוּן- הפרדת נוזל מזיהומים בלתי מסיסים מוצקים; מולקולות נוזל עוברות דרך הנקבוביות של המסנן, וחלקיקים גדולים של זיהומים נשמרים.
דמיינו שלפניכם תערובת של חול נהר ומים. קבע את סוג התערובת. ( הֵטֵרוֹגֵנִי). השווה את התכונות הפיזיקליות של חול ומים נהרות. (אלו חומרים שאינם מסיסים זה בזה ובעלי צפיפות שונה). הצע שיטה להפרדת תערובת זו ( סִנוּן).
פעולה באמצעות מגנטהיא שיטה להפרדת תערובות הטרוגניות כאשר אחד החומרים בתערובת מסוגל להימשך על ידי מגנט
אידוי -זוהי שיטה להפרדת תערובות הומוגניות, שבה משתחרר מתמיסה חומר מסיס מוצק, כאשר בחימום המים מתאדים ונשארים גבישים של החומר המוצק.
זיקוק (לטינית עבור "הורדה") – זוהי שיטה להפרדת תערובות הומוגניות, שבה תערובות נוזליות מופרדות לשברים שונים בהרכבם. זה מתבצע על ידי אידוי חלקי של נוזל ואחריו עיבוי של קיטור. החלק המזוקק (התזקיק) מועשר בחומרים נדיפים יותר (בעלי רתיחה נמוכה), והנוזל הלא מזוקק (התחתון) מועשר בחומרים פחות נדיפים יחסית (בעלי רתיחה גבוהה).
במעבדה מתבצע הזיקוק באמצעות מתקן מיוחד (איור 6). כאשר מחממים תערובת של נוזלים, החומר בעל נקודת הרתיחה הנמוכה ביותר רותח ראשון. האדים שלו עוזבים את הכלי, מתקררים, מתעבים1, והנוזל שנוצר זורם לתוך המקלט. כאשר חומר זה אינו נמצא יותר בתערובת, הטמפרטורה תתחיל לעלות, ועם הזמן ירתח מרכיב נוזלי נוסף. נוזלים לא נדיפים נשארים בכלי.

אורז. 6. מתקן מעבדה לזיקוק: א - קונבנציונלי; ב - מפושט
1 - תערובת של נוזלים עם נקודות רתיחה שונות;
2 - מדחום;
3 - מקרר מים;
4 - מקלט
בואו נסתכל איך כמה משתמשים שיטות הפרדת תערובות.
תהליך הסינון עומד בבסיס פעולתה של מכונת הנשמה - מכשיר המגן על ריאותיו של אדם שעובד בחדר מאובק מאוד. למכשיר הנשמה יש מסננים המונעים כניסת אבק לריאות (איור 7). מכשיר ההנשמה הפשוט ביותר הוא תחבושת העשויה מכמה שכבות של גזה. לשואב אבק יש גם פילטר שמסיר אבק מהאוויר.
 אורז. 7. עובד במכונת הנשמה
אורז. 7. עובד במכונת הנשמה
סכמו באילו שיטות ניתן להפריד תערובת של חומרים מסיסים ובלתי מסיסים במים.
נושא: "שיטות הפרדת תערובות" (כיתה ח')
בלוק תיאורטי.
הגדרת המושג "תערובת" ניתנה במאה ה-17. המדען האנגלי רוברט בויל: "תערובת היא מערכת אינטגרלית המורכבת ממרכיבים הטרוגניים."
מאפיינים השוואתיים של התערובת והחומר הטהור
|
סימני השוואה |
חומר טהור |
תַעֲרוֹבֶת |
|
קָבוּעַ |
הֲפַכְפַּך |
|
|
חומרים |
אותו |
שׁוֹנִים |
|
תכונות גשמיות |
קבוע |
הֲפַכְפַּך |
|
שינוי אנרגיה במהלך היווצרות |
מתרחש |
לא קורה |
|
הַפרָדָה |
על ידי שימוש ב תגובה כימית |
בשיטות פיזיות |
התערובות נבדלות זו מזו במראה.
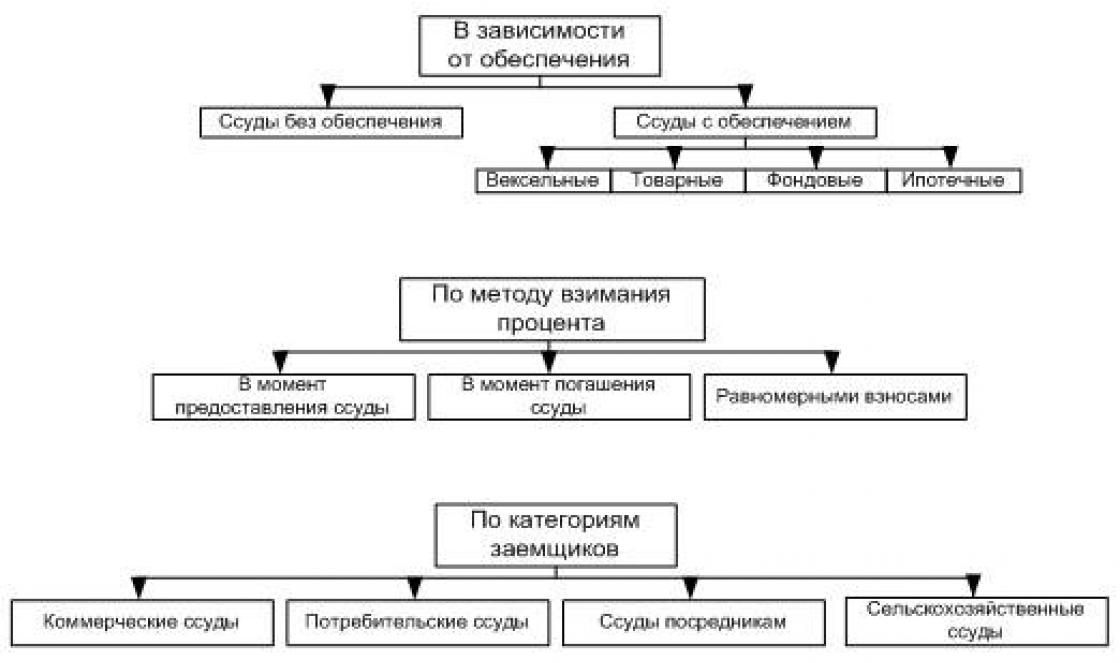
סיווג התערובות מוצג בטבלה:
ניתן דוגמאות לתרחיפים (חול נהר + מים), אמולסיות (שמן צמחי + מים) ותמיסות (אוויר בבקבוק, מלח שולחני + מים, חילוף קטן: אלומיניום + נחושת או ניקל + נחושת).
שיטות להפרדת תערובות
בטבע קיימים חומרים בצורה של תערובות. למחקר מעבדתי, לייצור תעשייתי ולצורכי פרמקולוגיה ורפואה יש צורך בחומרים טהורים.
שיטות שונות להפרדת תערובות משמשות לטיהור חומרים.

אידוי הוא הפרדה של מוצקים מומסים בנוזל על ידי הפיכתו לקיטור.

זִקוּק-זיקוק, הפרדה של חומרים הכלולים בתערובות נוזליות לפי נקודות רתיחה, ולאחר מכן קירור הקיטור.
בטבע המים אינם מתרחשים בצורתם הטהורה (ללא מלחים). אוקיינוס, ים, נהר, באר ומי מעיינות הם סוגים של תמיסות של מלחים במים. עם זאת, אנשים זקוקים לרוב למים נקיים שאינם מכילים מלחים (המשמשים במנועי מכוניות; בייצור כימי להשגת תמיסות וחומרים שונים; בהכנת צילומים). מים כאלה נקראים מזוקקים, ושיטת קבלתם נקראת זיקוק.
סינון - סינון נוזלים (גזים) דרך מסנן על מנת לנקותם מזיהומים מוצקים.

שיטות אלו מבוססות על הבדלים בתכונות הפיזיקליות של מרכיבי התערובת.
שקול שיטות הפרדה הֵטֵרוֹגֵנִי ותערובות הומוגניות.
|
דוגמה לתערובת |
שיטת הפרדה |
|
השעיה - תערובת של חול נהר ומים |
פְּרַקְלִיטוּת הַפרָדָה מגןמבוסס על צפיפויות שונותחומרים. חול כבד יותר שוקע בתחתית. אפשר גם להפריד את האמולסיה: להפריד את השמן או השמן הצמחי מהמים. במעבדה ניתן לעשות זאת באמצעות משפך הפרדה. נפט או שמן צמחי מהווים את השכבה העליונה והקלה יותר. כתוצאה מהשקיעה, טל נושר מתוך הערפל, פיח שוקע מהעשן, ושמנת מתיישבת בחלב. הפרדה של תערובת של מים ושמן צמחי על ידי התיישבות |
|
תערובת של חול ומלח שולחן במים |
סִנוּן מהו הבסיס להפרדה של תערובות הטרוגניות באמצעות סִנוּן?על מסיסות שונה של חומרים במים ועל גדלי חלקיקים שונים. רק חלקיקים של חומרים דומים להם עוברים דרך נקבוביות המסנן, בעוד שחלקיקים גדולים יותר נשמרים על המסנן. כך ניתן להפריד תערובת הטרוגנית של מלח שולחני וחול נהר. חומרים נקבוביים שונים יכולים לשמש כמסננים: צמר גפן, פחם, חימר אפוי, זכוכית דחוסה ואחרים. שיטת הסינון היא בסיס העבודה מכשירי חשמל ביתיים, כגון שואבי אבק. הוא משמש על ידי מנתחים - תחבושות גזה; מקדחים ועובדי מעליות - מסכות נשימה. באמצעות מסננת תה לסינון עלי תה, הצליח אוסטאפ בנדר, גיבור היצירה של אילף ופטרוב, לקחת את אחד הכיסאות מאלוצ'קה האוגרס ("שנים עשר כסאות"). הפרדת תערובת עמילן ומים על ידי סינון |
|
תערובת של ברזל ואבקת גופרית |
פעולה באמצעות מגנט או מים אבקת ברזל נמשכה על ידי מגנט, אבל אבקת גופרית לא. אבקת גופרית בלתי ניתנת להרטבה צפה אל פני המים, ואבקת ברזל כבדה הניתנת להרטבה שקעה בקרקעית. הפרדת תערובת של גופרית וברזל באמצעות מגנט ומים
|
|
תמיסה של מלח במים היא תערובת הומוגנית |
אידוי או התגבשות המים מתאדים ומשאירים גבישי מלח בכוס החרסינה. כאשר מים מתאדים מהאגמים אלטון ובסקונצ'אק, מלח שולחן. שיטת הפרדה זו מתבססת על ההבדל בנקודות הרתיחה של הממס והמומס, אם חומר, למשל סוכר, מתפרק בחימום, אז המים לא מתאדים לחלוטין - התמיסה מתאדה, ואז משקעים גבישי סוכר מ. התמיסה הרוויה.לפעמים יש צורך להסיר זיהומים מממסים עם רתיחה בטמפרטורה נמוכה יותר, למשל מים ממלח. במקרה זה, יש לאסוף את אדי החומר ולאחר מכן לעבות עם הקירור. שיטה זו של הפרדת תערובת הומוגנית נקראת זיקוק או זיקוק. במכשירים מיוחדים - מזקקים מתקבלים מים מזוקקים המשמשים לצרכי פרמקולוגיה, מעבדות ומערכות קירור לרכב. בבית אתה יכול לבנות מזקק כזה: אם תפריד תערובת של אלכוהול ומים, אז האלכוהול עם נקודת רתיחה = 78 מעלות צלזיוס יזוקק תחילה (נאסף במבחנה מקבלת), ומים יישארו במבחנה. הזיקוק משמש להפקת בנזין, נפט ושמן גז מנפט. הפרדה של תערובות הומוגניות |
שיטה מיוחדת להפרדת רכיבים, המבוססת על ספיגתם השונה על ידי חומר מסוים, היא כרומטוגרפיה.
באמצעות כרומטוגרפיה, הבוטנאי הרוסי M. S. Tsvet היה הראשון לבודד כלורופיל מהחלקים הירוקים של הצמחים. בתעשייה ובמעבדות משתמשים בעמילן, פחם, אבן גיר ותחמוצת אלומיניום במקום נייר סינון לכרומטוגרפיה. האם תמיד נדרשים חומרים באותה דרגת טיהור?
למטרות שונות נדרשים חומרים בעלי דרגות טיהור שונות. יש להשאיר את מי הבישול לעמוד מספיק כדי להסיר זיהומים וכלור המשמש לחיטוי אותם. תחילה יש להרתיח מים לשתייה. ובמעבדות כימיות להכנת תמיסות ועריכת ניסויים, ברפואה, יש צורך במים מזוקקים, מטוהרים ככל האפשר מחומרים המומסים בהם. חומרים טהורים במיוחד, שתכולת הזיהומים בהם אינה עולה על מיליונית האחוז, משמשים בתעשיות אלקטרוניקה, מוליכים למחצה, טכנולוגיה גרעינית ותעשיות דיוק אחרות.
שיטות לביטוי הרכב התערובות.
חלק המוני של הרכיב בתערובת- היחס בין מסת הרכיב למסה של כל התערובת. בדרך כלל שבר המסה מתבטא ב-%, אך לא בהכרח.
ω ["אומגה"] = m רכיב / m תערובת
שבר שומה של הרכיב בתערובת- היחס בין מספר השומות (כמות החומר) של רכיב למספר השומות הכולל של כל החומרים בתערובת. לדוגמה, אם התערובת מכילה חומרים A, B ו-C, אז:
χ ["chi"] רכיב A = n רכיב A / (n(A) + n(B) + n(C))
יחס מולארי של רכיבים.לפעמים בעיות בתערובת מעידות על היחס המולארי של מרכיביה. לדוגמה:
n רכיב A: n רכיב B = 2:3
חלק נפח של הרכיב בתערובת (רק לגזים)- היחס בין נפח החומר A לנפח הכולל של תערובת הגז כולה.
φ ["phi"] = רכיב V / תערובת V
בלוק מעשי.
בואו נסתכל על שלוש דוגמאות לבעיות שבהן תערובות של מתכות מגיבות איתן מלחחוּמצָה:
דוגמה 1.כאשר נחשפה תערובת של נחושת וברזל במשקל 20 גרם לעודף חומצה הידרוכלורית, השתחררו 5.6 ליטר גז (מס'). קבע את שברי המסה של מתכות בתערובת.
בדוגמה הראשונה, נחושת אינה מגיבה עם חומצה הידרוכלורית, כלומר, מימן משתחרר כאשר החומצה מגיבה עם ברזל. לפיכך, לדעת את נפח המימן, נוכל למצוא מיד את הכמות והמסה של הברזל. ובהתאם, שברי המסה של החומרים בתערובת.
פתרון לדוגמה 1.
מציאת כמות המימן:
n = V / V m = 5.6 / 22.4 = 0.25 מול.
לפי משוואת התגובה:
כמות הברזל היא גם 0.25 מול. אתה יכול למצוא את המסה שלו:
m Fe = 0.25 56 = 14 גרם.
תשובה: 70% ברזל, 30% נחושת.
דוגמה 2.כאשר נחשפה תערובת של אלומיניום וברזל במשקל 11 גרם לעודף חומצה הידרוכלורית, השתחררו 8.96 ליטר גז (נ.ש). קבע את שברי המסה של מתכות בתערובת.
בדוגמה השנייה, התגובה היא שניהםמַתֶכֶת כאן, מימן כבר משתחרר מהחומצה בשתי התגובות. לכן, לא ניתן להשתמש כאן בחישוב ישיר. במקרים כאלה, נוח לפתור באמצעות מערכת משוואות פשוטה מאוד, כאשר x הוא מספר המולות של אחת המתכות, ו-y הוא כמות החומר של השנייה.
פתרון לדוגמה 2.
2HCl = FeCl 2+
הרבה יותר נוח לפתור מערכות כאלה בשיטת החיסור, להכפיל את המשוואה הראשונה ב-18:
27x + 18y = 7.2
והפחתת המשוואה הראשונה מהשנייה:(56 - 18) y = 11 - 7.2
y = 3.8 / 38 = 0.1 מול (Fe)
x = 0.2 מול (Al)
מציאת כמות המימן:
n = V / V m = 8.96 / 22.4 = 0.4 מול.
תן לכמות האלומיניום להיות x שומות, וכמות הברזל תהיה x שומות. אז נוכל לבטא את כמות המימן המשתחררת במונחים של x ו-y:
אנו יודעים את הכמות הכוללת של מימן: 0.4 מול. אומר,
1.5x + y = 0.4 (זו המשוואה הראשונה במערכת).
עבור תערובת של מתכות אנחנו צריכים לבטא המוניםדרך כמות החומרים.
m = Mn
אז, המסה של אלומיניום
m Al = 27x,
מסה של ברזל
m Fe = 56у,
ואת המסה של כל התערובת
27x + 56y = 11 (זו המשוואה השנייה במערכת).
אז יש לנו מערכת של שתי משוואות:
m Fe = n M = 0.1 56 = 5.6 גרם
m Al = 0.2 27 = 5.4 גרם
ω Fe = m Fe / m תערובת = 5.6 / 11 = 0.50909 (50.91%),
בהתאמה,
ω Al = 100% - 50.91% = 49.09%
תשובה: 50.91% ברזל, 49.09% אלומיניום.
דוגמה 3.16 גרם של תערובת של אבץ, אלומיניום ונחושת טופלו בעודף של תמיסת חומצה הידרוכלורית. במקרה זה, השתחררו 5.6 ליטר גז (נ.ש.) ו-5 גרם מהחומר לא התמוססו. קבע את שברי המסה של מתכות בתערובת.
בדוגמה השלישית, שתי מתכות מגיבות, אך המתכת השלישית (נחושת) אינה מגיבה. לכן, היתרה של 5 גרם היא מסת הנחושת. ניתן למצוא את הכמויות של שתי המתכות הנותרות - אבץ ואלומיניום (שימו לב שהמסה הכוללת שלהן היא 16 − 5 = 11 גרם) באמצעות מערכת משוואות, כמו בדוגמה מס' 2.
תשובה לדוגמא 3: 56.25% אבץ, 12.5% אלומיניום, 31.25% נחושת.
דוגמה 4.תערובת של ברזל, אלומיניום ונחושת טופלה בעודף של חומצה גופרתית מרוכזת קרה. במקרה זה, חלק מהתערובת התמוסס, והשתחררו 5.6 ליטר גז (נ.ש). התערובת שנותרה טופלה בעודף של תמיסת נתרן הידרוקסיד. השתחררו 3.36 ליטר גז ונשארו 3 גרם שאריות לא מומסות. קבע את המסה וההרכב של תערובת המתכות הראשונית.
בדוגמה זו, עלינו לזכור זאת קר מרוכזחומצה גופרתית אינה מגיבה עם ברזל ואלומיניום (פסיבציה), אך מגיבה עם נחושת. זה משחרר תחמוצת גופרית (IV).
עם אלקלימגיב רק אלומיניום- מתכת אמפוטרית (בנוסף לאלומיניום, אבץ ופח גם מתמוססים באלקליות, וניתן להמיס בריליום גם באלקלי חם מרוכז).
פתרון לדוגמה 4.
(אל תשכח שיש להשוות תגובות כאלה באמצעות מאזן אלקטרוני)
מכיוון שהיחס המולארי של נחושת וגופרית דו חמצני הוא 1:1, אז הנחושת היא גם 0.25 מול. אתה יכול למצוא מסה של נחושת:
m Cu = n M = 0.25 64 = 16 גרם.אלומיניום מגיב עם תמיסה אלקלית, וכתוצאה מכך נוצר קומפלקס הידרוקסו של אלומיניום ומימן:
2Al + 2NaOH + 6H 2 O = 2Na + 3H 2Al 0 − 3e = Al 3+
2H + + 2e = H 2
מספר שומות מימן:
n H3 = 3.36 / 22.4 = 0.15 מול,
היחס המולארי של אלומיניום ומימן הוא 2:3 ולכן,
n Al = 0.15 / 1.5 = 0.1 מול.
משקל אלומיניום:
m Al = n M = 0.1 27 = 2.7 גרםהשאר הוא ברזל, במשקל 3 גרם. ניתן למצוא את המסה של התערובת:
תערובת מ' = 16 + 2.7 + 3 = 21.7 גרם.שברי מסה של מתכות:
רק נחושת מגיבה עם חומצה גופרתית מרוכזת, מספר מולות הגז הוא:
n SO2 = V / Vm = 5.6 / 22.4 = 0.25 מול
|
2H 2 SO 4 (ריכוז) = CuSO 4+ |
ω Cu = m Cu / m תערובת = 16 / 21.7 = 0.7373 (73.73%)
ω Al = 2.7 / 21.7 = 0.1244 (12.44%)
ω Fe = 13.83%
תשובה: 73.73% נחושת, 12.44% אלומיניום, 13.83% ברזל.
דוגמה 5.21.1 גרם של תערובת של אבץ ואלומיניום הומס ב-565 מ"ל תמיסת חומצה חנקתית המכילה 20 wt. %HNO 3 ובעל צפיפות של 1.115 גרם/מ"ל. נפח הגז המשוחרר, שהוא חומר פשוט והתוצר היחיד של הפחתת חומצה חנקתית, היה 2.912 ליטר (נ.ש). קבע את הרכב התמיסה המתקבלת באחוזים מסה. (RHTU)
הטקסט של בעיה זו מציין בבירור את התוצר של הפחתת חנקן - "חומר פשוט". מכיוון שחומצה חנקתית עם מתכות אינה מייצרת מימן, היא חנקן. שתי המתכות מומסות בחומצה.
הבעיה אינה שואלת את הרכב תערובת המתכות הראשונית, אלא את הרכב התמיסה שנוצרה לאחר התגובות. זה מקשה על המשימה.
פתרון לדוגמה 5.
קבע את כמות חומר הגז:
n N2 = V / Vm = 2.912 / 22.4 = 0.13 מול.
קבע את המסה של תמיסת החומצה החנקתית, המסה והכמות של HNO3 המומס:
m פתרון = ρ V = 1.115 565 = 630.3 גרם
m HNO3 = ω m תמיסה = 0.2 630.3 = 126.06 גרם
n HNO3 = m / M = 126.06 / 63 = 2 מול
שימו לב שמכיוון שהמתכות התמוססו לחלוטין, זה אומר - בהחלט היה מספיק חומצה(מתכות אלו אינן מגיבות עם מים). בהתאם, יהיה צורך לבדוק האם יש יותר מדי חומצה?, וכמה ממנו נשאר לאחר התגובה בתמיסה שנוצרה.
אנו מרכיבים משוואות תגובה ( אל תשכח את היתרה האלקטרונית שלך) ולנוחות החישובים, אנו לוקחים פי 5 את כמות האבץ, ו-10y ככמות האלומיניום. ואז, בהתאם למקדמים במשוואות, חנקן בתגובה הראשונה יהיה x מול, ובשני - 3y mol:
|
12HNO 3 = 5Zn(NO 3) 2+ |
|
Zn 0 − 2e = Zn 2+ |
||
|
2N +5 + 10e = N 2 |
|
36HNO3 = 10Al(NO3)3 + |
נוח לפתור מערכת זו על ידי הכפלת המשוואה הראשונה ב-90 והפחתת המשוואה הראשונה מהשנייה.
x = 0.04, כלומר n Zn = 0.04 5 = 0.2 מול
y = 0.03, כלומר n Al = 0.03 10 = 0.3 מול
בואו נבדוק את המסה של התערובת:
0.2 65 + 0.3 27 = 21.1 גרם.
כעת נעבור להרכב הפתרון. יהיה נוח לכתוב שוב את התגובות ולרשום מעל התגובות את הכמויות של כל החומרים שהגיבו והיווצרו (למעט מים):
השאלה הבאה היא: האם נותרה חומצה חנקתית בתמיסה וכמה נשארה?
לפי משוואות התגובה, כמות החומצה שהגיבה:
n HNO3 = 0.48 + 1.08 = 1.56 מול,
הָהֵן. החומצה הייתה בעודף ואתה יכול לחשב את השארית שלה בתמיסה:
n HNO3 מנוחה. = 2 - 1.56 = 0.44 מול.
אז, ב פתרון סופימכיל:
חנקתי אבץ בכמות של 0.2 מול:
m Zn(NO3)2 = n M = 0.2 189 = 37.8 גרם
חנקתי אלומיניום בכמות של 0.3 מול:
m Al(NO3)3 = n M = 0.3 213 = 63.9 גרם
עודף חומצה חנקתית בכמות של 0.44 מול:
m HNO3 מנוחה. = n M = 0.44 63 = 27.72 גרם
מהי המסה של הפתרון הסופי?
הבה נזכור שהמסה של התמיסה הסופית מורכבת מאותם רכיבים שערבבנו (תמיסות וחומרים) בניכוי תוצרי התגובה שיצאו מהתמיסה (משקעים וגזים):
ואז למשימה שלנו:
מ חדש תמיסה = מסה של תמיסת חומצה + מסה של סגסוגת מתכת - מסה של חנקן
m N2 = n M = 28 (0.03 + 0.09) = 3.36 גרם
מ חדש תמיסה = 630.3 + 21.1 - 3.36 = 648.04 גרם
ωZn(NO 3) 2 = כמות m / m פתרון = 37.8 / 648.04 = 0.0583
ωAl(NO 3) 3 = m נפח / m פתרון = 63.9 / 648.04 = 0.0986
ω HNO3 מנוחה. = m מים / m פתרון = 27.72 / 648.04 = 0.0428
תשובה: 5.83% חנקתי אבץ, 9.86% חנקת אלומיניום, 4.28% חומצה חנקתית.
דוגמה 6.כאשר 17.4 גרם של תערובת של נחושת, ברזל ואלומיניום טופלו בעודף של חומצה חנקתית מרוכזת, השתחררו 4.48 ליטר גז (n.o.), וכאשר תערובת זו נחשפה לאותה מסה של עודף חומצה הידרוכלורית, 8.96 ליטר של גז. שוחררו גזים (לנו. י). קבע את הרכב התערובת הראשונית. (RHTU)
כשפותרים בעיה זו, עלינו לזכור, ראשית, שחומצה חנקתית מרוכזת עם מתכת לא פעילה (נחושת) מייצרת NO 2, וברזל ואלומיניום אינם מגיבים איתה. חומצה הידרוכלורית, להיפך, אינה מגיבה עם נחושת.
תשובה למשל 6: 36.8% נחושת, 32.2% ברזל, 31% אלומיניום.
הערת הסברחומרים טהורים ו תערובות. שיטות הַפרָדָה תערובות. לפתח הבנה של חומרים טהורים ו תערובות. שיטותטיהור חומרים: ... חומרים שונים שיעורים תרכובות אורגניות. מאפיין: בסיסי שיעוריםתרכובות אורגניות...
צו 2013 מס' תכנית עבודה למקצוע האקדמי "כימיה" כיתה ח' (רמה בסיסית 2 שעות)
תוכנית עבודההערכת הידע של התלמידים בהזדמנויות ו דרכים הַפרָדָה תערובותחומרים; גיבוש מיומנויות ניסוי מתאימות... סיווג ו תכונות כימיותחומרים בסיסיים שיעוריםתרכובות אנאורגניות, היווצרות רעיונות על...
... תערובות, דרכים הַפרָדָה תערובות. מטרות: לתת את הרעיון של חומרים טהורים ו תערובות; שקול סיווג תערובות; הציגו לתלמידים דרכים הַפרָדָה תערובות... תלמיד ומעלה מלפנים מעמדכרטיס עם הנוסחה של חומר לא אורגני...
בכימיה יש מושגים של חומרים ותערובות טהורים. הטהורים מכילים מולקולות של חומר אחד בלבד. בטבע שולטות תערובות המורכבות מחומרים שונים.
מושגים
ניתן לחלק את כל החומרים לשתי קטגוריות - טהור ומעורב. חומרים טהורים כוללים יסודות ותרכובות המורכבות מאטומים, מולקולות או יונים זהים. אלו חומרים בעלי הרכב קבוע השומרים על תכונות קבועות.
דוגמאות לחומרים טהורים הם:
- מתכות וגזים אצילים המורכבים מאטומים;
- מים, המורכבים ממולקולות מים;
- מלח שולחן, המורכב מקטיוני נתרן ואניוני כלור.

אורז. 1. חומרים טהורים.
אם מוסיפים סוכר למים, הוא מפסיק להיות חומר טהור ונוצרת תערובת. תערובות מורכבות מכמה חומרים טהורים בעלי מבנים שונים, הנקראים רכיבים. לתערובות יכול להיות כל מצב צבירה. לדוגמה, אוויר הוא תערובת של גזים שונים (חמצן, מימן, חנקן), בנזין הוא תערובת של חומרים אורגניים, פליז הוא תערובת של אבץ ונחושת.

אורז. 2. תערובות.
כל חומר שומר על תכונותיו, ולכן מים עם מלח מלוחים, וסגסוגת עם ברזל נמשכת על ידי מגנט. עם זאת, תכונות התערובת עצמה עשויות להשתנות בהתאם להרכב הכמותי והאיכותי של הרכיבים. כך למשל מים מזוקקים שעברו טיהור מירבי, בהתאם לחומרים המוספים, יכולים לקבל טעם מתוק, חמוץ, מלוח או חמוץ-מלוח. יתרה מכך, ככל שהריכוז של חומר מסוים גבוה יותר, כך טעם מסוים בולט יותר.
מבנה התערובות יכול להיות הומוגני או לשלב חומרים במצבי צבירה שונים. בהתאם לכך, הם מבחינים:
- הומוגנית או הומוגנית - לא ניתן לזהות חלקיקים ללא ניתוח כימי, האינדיקטור שלהם זהה בכל מקום בדגימה (סגסוגת מתכת);
- הטרוגנית או הטרוגנית - קל לזהות חלקיקים, התדירות שלהם אינה אחידה מקומות שוניםתערובות (מים וחול).
תערובות הטרוגניות כוללות:
- השעיות - תערובות של חומרים מוצקים ונוזליים (פחם ומים);
- תחליבים - תערובות של נוזלים בצפיפויות שונות (שמן ומים).
אם מרכיב אחד קטן פי עשרה במסתו ממרכיב אחר, אז זה נקרא טומאה.
שיטות ניקוי
אין חומרים טהורים לחלוטין. חומרים טהורים נחשבים לחומרים המכילים כמות קטנה של זיהומים שאינם משפיעים על התכונות הפיזיקליות והכימיות של החומר. כדי לטהר את החומר ככל האפשר, אנו משתמשים שיטות להפרדת תערובות:
- שקיעה - שקיעה של חומרים כבדים בנוזלים;
- סינון - הפרדת חלקיקים מנוזל באמצעות מסננים;
- אידוי - חימום התמיסה עד שהלחות מתאדה;
- יישום מגנט - בחירה באמצעות מגנטיזציה;
- זיקוק - הפרדה של חומרים בעלי נקודות רתיחה שונות;
- ספיחה היא הצטברות של חומר אחד על פני השטח של חומר אחר.
ניתן להפריד מתכות מתכות שאינן מתכות באמצעות ציפה. זהו תהליך המבוסס על יכולתם של חומרים להירטב. כך מפרידים את הברזל מהגופרית: הברזל נרטב ומתיישב בקרקעית, אך הגופרית לא נרטבת ונשארת על פני המים.

אורז. 3. ציפה.
מה למדנו?
משיעור כימיה בכיתה ח' למדנו על מושגי תערובות וחומרים טהורים. יסודות ותרכובות המורכבות ממולקולות הומוגניות, אטומים או יונים, וגם בעלי תכונות קבועות, נקראים טהורים. תערובות כוללות מספר חומרים טהורים בריכוזים ומבנים שונים. תרכובות יכולות להתערבב לחלוטין, ליצור חומרים הומוגניים, או לשלב בצורה הטרוגנית. להפרדת תערובות נעשה שימוש בשיטות שונות.
מבחן על הנושא
הערכת הדו"ח
דירוג ממוצע: 4.5. סך הדירוגים שהתקבלו: 277.
מטרות השיעור:
חינוכי - צור תנאים להיכרות עם המושג תערובות הומוגניות ואי-הומוגניות, חומר טהור כבעל תכונות קבועות, הראה את ההבדל שלו מתערובות. הצג מגוון שיטות להפרדת תערובות.
חינוכי - צור תנאים ליצירת עניין בידע, מיומנויות והערכה נאותה של הפעילויות של האדם. להמשיך בחינוך סביבתי וכיבוד הסביבה.
התפתחותית - ליצור תנאים להמשך פיתוח מיומנויות התלמידים להרכיב נוסחאות של חומרים אי-אורגניים לפי שם ולשמות חומרים לפי נוסחאות; המשך פיתוח מיומנויות התלמידים בזיהוי כיתות של תרכובות אנאורגניות באמצעות נוסחאות; פיתוח היכולת לזהות חומרים טהורים ותערובות של חומרים; פיתוח יכולת לערוך תכנית פעולה להפרדת תערובות חומרים; פיתוח יכולת הפרדת תערובות על ידי שקיעה, סינון, שימוש במגנט ואידוי.
מטרות לתלמיד:
-לדעת את המושג של חומר טהור
- להכיר את המושגים של תערובות הטרוגניות והומוגניות
– להכיר את שיטות הפרדת התערובות: שקיעה, סינון, אידוי, זיקוק
הכר שיטות מודרניות לטיהור מים
להיות מסוגלים להפריד בין תערובות על ידי שקיעה, סינון, שימוש במגנט, אידוי
במהלך השיעורים
1. רגע ארגוני
(ארגון תחילת השיעור)
ברכה, יצירת רקע רגשי חיובי, בדיקת הנוכחים, בדיקת מוכנות לשיעור.
2. בדיקת השלמת שיעורי בית (בדיקת שיעורי בית)
§ 1
משימות 7-10
§ 4
3. הצבת יעדים, מוטיבציה (מסר הנושא, מטרות השיעור)
נושא השיעור: חומרים ותערובות טהורים. שיטות להפרדת תערובות.
אילו יעדים לדעתך נוכל להציב לשיעור של היום?
(יעדים לתלמיד)
אנחנו מודעים היטב למה זה ניקיון. חדר נקי, מחברת נקייה, בגדים נקיים... מה פירוש המושג חומר טהור? במה שונה חומר טהור מתערובת של חומרים?
4. עדכון ידע ומיומנויות בסיסיות
בואו נגלה את השאלות: איך קוראים לחומר? (חומר הוא ממה עשויים גופים פיזיים)
5. לימוד חומר חדש (לימוד ידע ושיטות פעולה חדשות)
חומר טהור.
בשני כלים, מי ים מזוקקים וחוממו לרתיחה. לאחר זמן מסוים נמדדו טמפרטורות הרתיחה בכלים אלו). התלמידים דנים בתוצאות הניסוי. הבעיה-שאלה שמשמיע המורה עולה באופן טבעי: "מדוע ה-t bp של מי הים אינו קבוע בפרקי זמן שונים, בהשוואה ל-t bp של מים מזוקקים." התלמידים מסכמים כי מליחות מי הים משפיעה על t kip.בעזרת המורה מתגבשת ההגדרה: "חומר טהור הוא חומר בעל תכונות פיזיקליות קבועות (נקודות רתיחה, נקודות התכה, צפיפות).
תערובות וסיווגם
המורה מזמין את התלמידים לבחון את התערובות שעל שולחן ההדגמה. לאחר מכן, החבר'ה מגדירים תערובת כשילוב של כמה חומרים שנמצאים במגע ישיר זה עם זה. המורה מוסיפה שאין בטבע חומרים טהורים לחלוטין. חומרים נמצאים בעיקר בצורת תערובות. הוא מדבר על אוויר כתערובת המורכבת מגזים - חנקן, חמצן, ארגון וכו'. זיהום אוויר: שינויים בתכולת הגופרית והגופרית הדו-חמצנית באוויר מביאים להצהבה או שינוי צבע של עלי העץ ולגמדות. בבני אדם, גז זה מגרה את דרכי הנשימה העליונות. עלייה בתכולת הפחמן החד חמצני באוויר מביאה לירידה ביכולת של המוגלובין בתאי הדם האדומים לשאת חמצן, מה שגורם להאטה של תגובות האדם, להיחלשות התפיסה, לכאבי ראש, ישנוניות ובחילות. בהשפעת כמויות גדולות של פחמן חד חמצני עלולות להתרחש התעלפות, תרדמת ואפילו מוות.
הנוזל העכור הזה הוא תערובת של מים וגיר. חלקיקי גיר בתערובת נראים לעין בלתי מזוינת. עם זאת, לפי מראה חיצונילא תמיד אפשר לנחש שמדובר בתערובת. לדוגמה, חלב נראה לנו הומוגני, אבל מתחת למיקרוסקופ ניתן לשים לב שהוא מורכב מטיפות של שומן ומולקולות חלבון הצפות בתמיסה. האם אתה חושב שמי גשמים הם חומר טהור? מה עם האוויר? לפניכם שתי כוסות עם נוזל שקוף, האחת מכילה מים, והשנייה תמיסה של סוכר במים. לא ניתן לראות חלקיקי סוכר לא רק בעין בלתי מזוינת, אלא אפילו במיקרוסקופ החזק ביותר. לפיכך, התערובות שונות. לאילו שתי קבוצות אפשר לחלק תערובות לפי מראה? (הומגני והטרוגני). נמלא את התרשים בכרטיסי העבודה. אילו תערובות נקראות הטרוגניות? (תערובות הטרוגניות הן אלו שבהן ניתן לראות חלקיקים מהחומרים המרכיבים את התערובת בעין בלתי מזוינת או בעזרת מיקרוסקופ.) אילו תערובות ניתן לכנות הומוגניות? (תערובות הומוגניות הן אלו שבהן, אפילו בעזרת מיקרוסקופ, לא ניתן לזהות חלקיקים של חומרים הכלולים בתערובת).
Homogeneous - תמיסות סוכר במים, NaCl, אוויר
הטרוגנית - תערובת של Fe + S, NaCl וסוכר, חימר עם מים
בדיקה ראשונית של הבנת ידע חדש
חבר'ה, האם אנחנו נתקלים לעתים קרובות בחומרים טהורים בטבע? (לא, תערובות של חומרים נפוצות יותר).
לפניך גרניט. מהי התערובת הזו או החומר הטהור הזה? (תַעֲרוֹבֶת).
איך ניחשת? (לגרניט יש מבנה גרגירי; חלקיקי קוורץ, נציץ ופלדספאר נראים בו.)
שיטות בסיסיות להפרדת תערובת.
ניסוי הדגמה "הפרדה של תערובת של שמן צמחי ומים."
הנה תערובת של שמן צמחי ומים. קבע את סוג התערובת. (הֵטֵרוֹגֵנִי). השוו את התכונות הפיזיקליות של שמן ומים. (אלו חומרים נוזליים שאינם מסיסים זה בזה ובעלי צפיפות שונה). הצע שיטה להפרדת תערובת זו. (הצעות של ילדים). שיטה זו נקראת התיישבות. זה מתבצע באמצעות משפך הפרדה. נמלא את הטבלה בכרטיסי העבודה "שיטות הפרדת תערובות הטרוגניות".
ניסוי הדגמה "הפרדת תערובות".
תערובת הטרוגנית של ברזל וגופרית. תערובת זו ניתן להפריד על ידי שיקוע, כי גופרית וברזל הם מוצקים שאינם מסיסים במים. אם תשפוך את התערובת הזו למים, הגופרית תצוף אל פני השטח והמגהץ ישקע. ניתן להפריד את התערובת הזו גם באמצעות מגנט, כי ברזל נמשך על ידי מגנט, אבל גופרית לא.
תערובת של חול ומים. זוהי תערובת הטרוגנית. הפרדנו אותו על ידי סינון.
דרכים שונות לסנן תערובות
סינון יכול להתבצע לא רק באמצעות מסנן נייר. ניתן להשתמש גם בחומרים בתפזורת או נקבוביות לסינון. חומרים בתפזורת המשמשים בשיטה זו כוללים, למשל, חול קוורץ. ולנקבובים - חימר אפוי וצמר זכוכית. יש גם את הרעיון של שיטת "הסינון החם". ניתן להשתמש בשיטה זו כדי להפריד בין תערובות מוצקים בעלות נקודות התכה שונות.
תמיסה של מלח במים. זוהי תערובת הומוגנית. הפרדנו אותו על ידי אידוי.
אבל עדיין יש דרכים להפריד בין תערובות הומוגניות. אחד מהם הוא כרומטוגרפיה.
היסטוריה של גילוי הכרומטוגרפיה
כרומטוגרפיה כשיטה להפרדת חומרים הוצעה בשנת 1903 על ידי הבוטנאי הרוסי מ.ס. צבע (1872–1919). הוא התעניין בבעיה האם הצבע הירוק הטבעי כלורופיל, שהוא חלק מעלי הצמח, הוא חומר בודד או תערובת של חומרים? כדי לברר, הוא מילא צינור זכוכית בגיר, הוסיף תמיסת כלורופיל לקצה אחד ושטף אותה בממס. נע לאורך הצינור, הכלורופיל יצר כמה אזורים שונים בצבע. כתוצאה מכך, המדען מצא שכלורופיל הוא תערובת של חומרים. הוא כינה את השיטה המוצעת להפרדת תערובות כרומטוגרפיה. בתרגום מילולי פירושו "ציור צבעוני".
דרך נוספת להפריד תערובת הומוגנית היא זיקוק או זיקוק.
היסטוריה של זיקוק
זיקוק בתרגום מלטינית פירושו "ירידה". התיאורים העתיקים ביותר של מעגל המזקק ניתנים בעבודתה של מרי על האלכימיה (זו המאה ה-1 לספירה). למזקק היה כלי, צינור יציאה ומקלט מקורר עם ספוג לח. אז זיקוק של נוזלים רותחים בו היה בלתי אפשרי. אפילו כמה מקלטים עם צינורות יכולים להיות מחוברים לכלי.
7. גיבוש ידע, גיבוש מיומנויות ראשוניות (גיבוש ידע ושיטות פעולה)
משימה מס' 1
תנו דוגמאות לתערובות שניתן להפריד על ידי סינון ושיקוע. כתבו את תשובתכם בטבלה.
משימה מס' 2
פקק כתוש נכנס בטעות לסוכר. איך מנקים ממנו סוכר?
משימה מס' 3
תן דוגמה לתערובת המורכבת משלושה חומרים ורשום את רצף הפעולות הדרושות להפרדה ביניהם.
8. הכללה ושיטתיות של ידע
כך, חבר'ה, הכרנו את השיטות העיקריות לטיהור חומרים (רשום אותם). מסקנה כללית: על מה מבוססת תמיד הפרדת התערובות? האם חומרים בתערובות שומרים על תכונותיהם? כתיבה במחברת: בתערובות, חומרים שומרים על תכונותיהם האישיות. הפרדת תערובות מבוססת על הבדלים תכונות גשמיותחומרים הכלולים בתערובת.
9. שליטה ובדיקה עצמית של ידע
השתמש בטבלה כדי לקבוע את הציוד הדרוש להפרדת התערובות המצוינות בה. מהאותיות המתאימות לתשובות הנכונות, תיצור שם של שיטה אחרת להשגת חומרים טהורים.
|
שם הציוד |
הרכב תערובת |
|||
|
שמן חמניות ומים |
חימר ומים |
מי ים |
ברזל ונחושת |
|
|
משפך כימי |
||||
|
משפך הפרדה |
||||
|
כּוֹס |
||||
|
מנורת אלכוהול |
||||
|
לְסַנֵן |
||||
|
כוס פורצלן |
||||
|
מַגנֵט |
||||
10. סיכום השיעור
בדיקת החידה, ציונים לעבודה בשיעור.
אין כתמים לבנים במפה,
כל כדור הארץ כבר מזמן פתוח,
אבל האמיצים ביותר מחכים
תגליות אמיתיות!
11. השתקפות
מה חדש למדת היום בכיתה?
מה אתה זוכר?
מה אהבת ומה לא עבד, לדעתך?
12. מידע על שיעורי בית והנחיות להשלמתם (שיעורי בית, התייעצות בנושא שיעורי בית)
§ 2
משימות 2, 4–6
דע את הגדרת המושגים: חומרים טהורים, תערובות הומוגניות ואי-הומוגניות; המהות של כל שיטה של הפרדת תערובות. ענה על שאלות 2, 4-6. אופציונלי: הכינו הודעה בנושא "יישום שיטות ניתוח כימי בעבודתם של קרימינולוגים, ארכיאולוגים, רופאים, היסטוריונים של אמנות" או יצירת תשבץ באמצעות מושגי השיעור של היום ושמות הציוד הדרוש להפרדת תערובות.
אם חלקיקים מפוזרים משתחררים באיטיות מהמדיום או שיש צורך בבירור מוקדם של מערכת הטרוגנית, משתמשים בשיטות כמו פקקולציה, ציפה, סיווג, קרישה וכו'.
קרישה היא תהליך של הידבקות חלקיקים במערכות קולואידיות (תחליבים או תרחיפים) עם היווצרות אגרגטים. הידבקות מתרחשת עקב התנגשות של חלקיקים במהלך תנועה בראונית. קרישה מתייחסת לתהליך ספונטני שנוטה לעבור למצב שיש לו נמוך יותר אנרגיה חינמית. סף הקרישה הוא הריכוז המינימלי של החומר הניתן שגורם לקרישה. באופן מלאכותי ניתן להאיץ את הקרישה באמצעות הוספת חומרים מיוחדים - קרישים - למערכת הקולואידית וכן באמצעות הפעלת שדה חשמלי על המערכת (אלקטרוקרישה), פעולה מכנית (רעידות, ערבוב וכו'.
במהלך הקרישה, לעתים קרובות מוסיפים כימיקלים מקרישים לתערובת ההטרוגנית המופרדת, אשר הורסים את הקליפות המומסות, תוך הפחתת חלק הדיפוזיה של השכבה החשמלית הכפולה הממוקמת על פני החלקיקים. זה מקל על צבירה של חלקיקים ויצירת אגרגטים. לפיכך, עקב היווצרותם של חלקים גדולים יותר מהפאזה המפוזרת, שקיעת החלקיקים מואצת. מלחי ברזל, אלומיניום או מלחים של מתכות רב ערכיות אחרות משמשים כחומרי קרישה.
פפטיזציה היא תהליך קרישה הפוך, שהוא פירוק של אגרגטים לחלקיקים ראשוניים. הפפטיזציה מתבצעת על ידי הוספת חומרים מפיצים למצע הפיזור. תהליך זה מקדם פירוק של חומרים לחלקיקים ראשוניים. חומרי חיטוי יכולים להיות פעילי שטח או אלקטרוליטים, כגון חומצות הומיות או כלוריד ברזל. תהליך הפפטיזציה משמש להשגת מערכות מפוזרות נוזל ממשחות או אבקות.
פלוקולציה, בתורה, היא סוג של קרישה. בתהליך זה, חלקיקים קטנים התלויים בגז או במדיה נוזלית יוצרים אגרגטים פקקים הנקראים פלוקים. פולימרים מסיסים, למשל, פוליאלקטרוליטים, משמשים כפלקולנטים. ניתן להסיר בקלות חומרים היוצרים פקקים במהלך הצקיפה באמצעות סינון או שקיעה. פלוקולציה משמשת לטיפול במים ולהפרדה של חומרים יקרי ערך משפכים וכן להעשרת מינרלים. במקרה של טיפול במים, משתמשים בפלקולנטים בריכוזים נמוכים (מ-0.1 עד 5 מ"ג/ליטר).
על מנת להרוס אגרגטים במערכות נוזלים, משתמשים בתוספים המעוררים מטענים על חלקיקים המונעים מהם להתקרב זה לזה. השפעה זו יכולה להיות מושגת גם על ידי שינוי ה-pH של הסביבה. שיטה זו נקראת defloculation.
ציפה היא תהליך של הפרדת חלקיקים הידרופוביים מוצקים משלב רציף נוזלי על ידי קיבועם באופן סלקטיבי בממשק שבין השלב הנוזלי והגזי (משטח המגע של נוזל וגז או פני הבועות בשלב הנוזל). חלקיקים מוצקים ותכלילי גז מוסרים מפני השטח של השלב הנוזלי. תהליך זה משמש לא רק להסרת חלקיקים מהפאזה המפוזרת, אלא גם להפרדת חלקיקים שונים בשל הבדלים בכושר ההרטבה שלהם. בתהליך זה, חלקיקים הידרופוביים מקובעים בממשק ומופרדים מחלקיקים הידרופיליים השוקעים לתחתית. תוצאות הציפה הטובות ביותר מתרחשות כאשר גודל החלקיקים הוא בין 0.1 ל-0.04 מ"מ.
ישנם מספר סוגי ציפה: קצף, שמן, סרט וכו'. הנפוץ ביותר הוא הצפת קצף. תהליך זה מאפשר לשאת חלקיקים שטופלו עם ריאגנטים אל פני המים באמצעות בועות אוויר. זה מאפשר היווצרות של שכבת קצף, שיציבותה מותאמת באמצעות תרכיז קצף.
הסיווג משמש במכשירים בעלי חתך משתנה. בעזרתו אפשר להפריד סכום מסויםחלקיקים קטנים מהמוצר העיקרי המורכב מחלקיקים גדולים. הסיווג מתבצע באמצעות צנטריפוגות והידרוסיקלונים בשל השפעת הכוח הצנטריפוגלי.
הפרדת מתלים באמצעות טיפול מגנטי של המערכת היא שיטה מבטיחה מאוד. מים שטופלו בשדה מגנטי שומרים על תכונות משתנות לאורך זמן, למשל, יכולת הרטבה מופחתת. תהליך זה מאפשר להעצים את הפרדת המתלים.